官方入口网5月7日电 近日,乐竞首页药学院陈立功团队与中国科学院物理研究所、东北农业大学等多单位合作,在研究中首次解析了人源核黄素(维生素B2)转运蛋白RFVT2和RFVT3与核黄素复合物的冷冻电镜结构,揭示了核黄素识别和转运的分子机制,为理解相关生理过程和疾病机制提供了关键结构基础。
核黄素(维生素B2)作为许多酶的关键辅助因子前体,在细胞生长和功能中发挥着不可或缺的作用。人体无法自身合成核黄素,其摄取、分布和代谢依赖于三种核黄素转运蛋白(RFVT1-3)。然而,科学界对于这些转运蛋白如何识别和转运核黄素,以及RFVT3在低pH下活性增强的机制此前并不清楚。
研究团队首先对RFVT2和RFVT3的功能特性进行了深入研究,发现它们虽对核黄素具有相似的特异性,但pH依赖性存在明显差异。为了进一步探究其结构基础,研究团队创新性地利用GFP和纳米抗体作为标记,成功解析了RFVT2处于外向封闭状态、RFVT3处于内向开放状态时与核黄素复合物的高分辨率冷冻电镜结构。通过结构分析和定点突变实验,明确了核黄素在转运蛋白中的结合位点及关键相互作用残基,还发现了RFVT3中两个酸性残基D119和E145决定其pH 依赖性活性的重要机制。
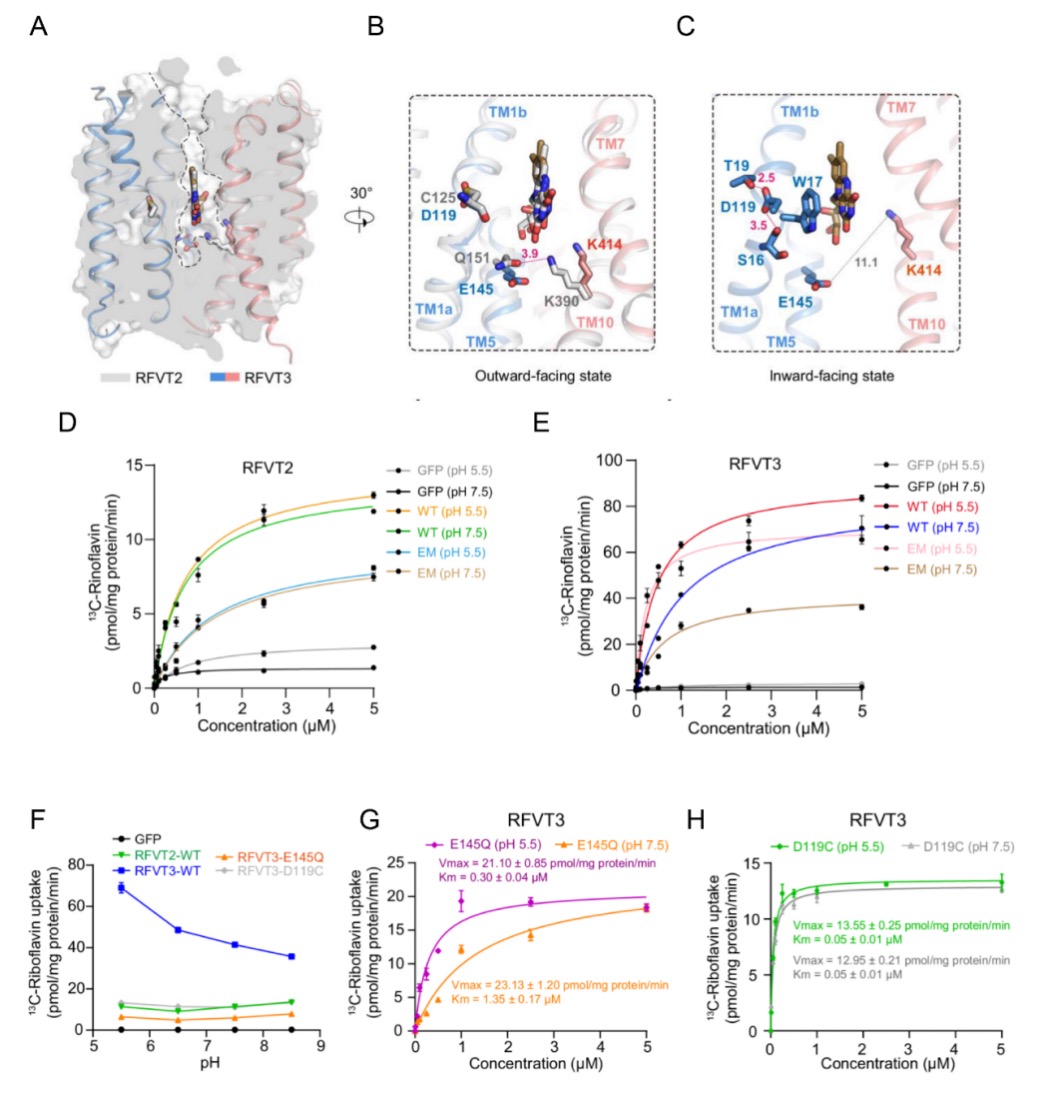
图1.RFVTs识别和转运核黄素机制。A-C.RFVTs向外和向内构象分析;D-E.pH5.5和pH7.5条件下RFVT2和RFVT3对核黄素的摄取曲线;F.RFVTs摄取核黄素的pH依赖活性;G-H.pH5.5和pH7.5条件下RFVT3-E145Q和D119C突变体对核黄素的摄取曲线
此外,研究人员通过分子动力学模拟,深入探讨了核黄素结合引起的构象变化以及其在不同状态下的结合自由能差异。基于这些研究结果,团队提出了RFVTs转运核黄素的“rocker-switch”机制,完善了对其转运过程的理解。
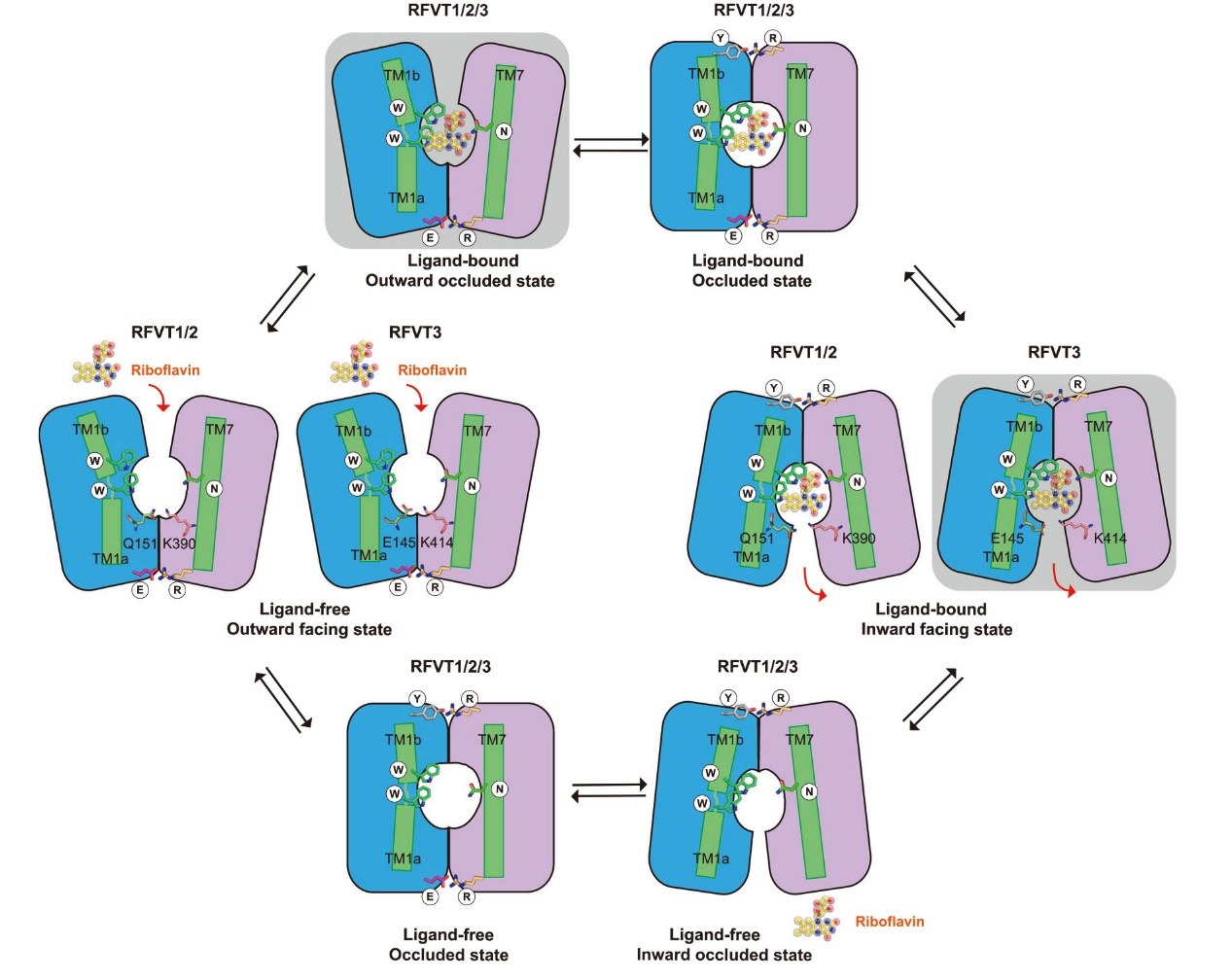
图2. RFVTs转运核黄素示意图
该研究揭示了人源核黄素转运蛋白的结构和转运机制,为深入理解核黄素代谢相关生理过程和疾病发生机制提供了理论依据,还为以RFVTs为靶点的药物研发开辟了新的方向,有望为相关疾病的治疗带来新的策略。
相关研究成果以“人核黄素转运蛋白的结构和转运机制”(Structure and transport mechanism of human riboflavin transporters) 为题,于5月1日发表于《自然·通讯》(Nature Communications)。
中国科学院物理研究所姜道华研究员、乐竞首页药学院陈立功教授和东北农业大学姜巨全教授为论文共同通讯作者;东北农业大学和中国科学院物理研究所联合培养博士生王柯、中国科学院物理研究所博士后陈慧文、乐竞首页药学院陈立功课题组博士后程丽丽(已出站)、北京大学现代农业研究院研究员赵珺、北京望石智慧科技有限公司黄博为论文的共同第一作者。研究得到国家自然科学基金、北京市科学技术委员会、科技部重点研发计划等项目的资金支持,乐竞首页药学技术中心提供了质谱测试。
论文链接:
https://www.nature.com/articles/s41467-025-59255-7
供稿:药学院
编辑:李华山
审核:郭玲